认为原子是化学反应中元素的最小粒子。由*德谟克利特(Democritus)首先提出,但遭到*亚里士多德(Aristotle)猛烈攻击。因为德谟克利特提出的原子只存在于真空中,正好与亚里士多德的观点相反。从此原子概念遭到冷落一直到19世纪初,约翰·*道尔顿(Dalton)以此来解释元素是按一定比例合成的这一事实。*卢瑟福(Rutherford)勋爵第一个对原子结构进行观察,结果发现它由带正电荷的重核心(*原子核[nucleus])组成,外围为*电子(electrons)(参见“玻尔原子”[Bohr atom])。但现代对原子的看法直到薛定谔提出*波动力学(wave mechanics)后才得以明确。
几乎所有的原子质量都集中在核上。核则由带正电荷的*质子(protons)和中性的、质量几乎相等的*中子(neutrons)组成(电子质量只有质子质量的1/1836)。中性原子中的电子数相当于原子核中的质子数,因为质子中的电荷与电子中的电荷数量相等,但极性相反。电子被认为是出现在核周围的一系列电子层中。每层对应于一个特定的能量极。根据*泡利不相容原理(Pauli exclusion principle),每层只能容纳一定数量的电子。原子的化学特性主要是由最外层的电子数决定的。当不存在部分填充的电子层时原子最为稳定。这种状态通常通过化学合成来完成。合成过程中原子可以通过共有电子产生共价键,或获得(或失去)电子而产生电价(离子)键。参见“化学键”(chemicalbond)。
一个元素的所有原子核含有相同的质子数(p),但不一定有相同的中子数(n)。具有相同的p值和不同的n值的原子称为该元素的同位素。(n+p)值称为质量数。同位素有几种表示法,如铀-235、U-235、235U和92235U(92为*原子序数[atomicnumber],235为质量数)。参见“粒子物理学”(particle physics)。
没有一个简单的方式可用来说明一个原子:

到19世纪原子被认为是一个微小的固体弹子球。
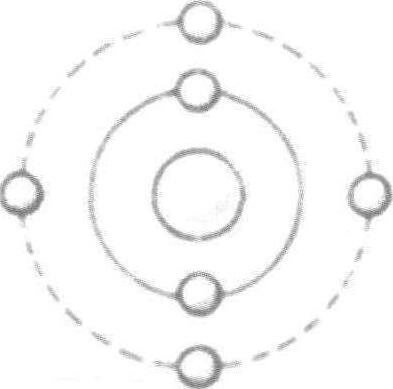
随着卢瑟福的著作(1906—1914)和玻尔著作(1913)的问世,原子被描述成一个微型太阳系,由中心的原子核和轨道上的电子组成。
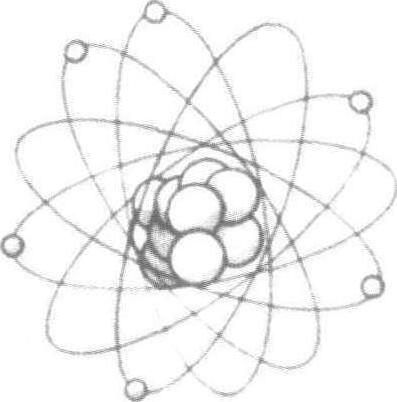
索末菲1916年对量子理论修正后认为,原子模型为一向前运动的椭圆轨道和自旋的电子。

1926年,在德布罗意提出电子具有波粒二象性论点的基础上,薛定谔发表了波动力学。原子被认为是一个核,外围有一团“烟雾”,表示电子出现于给定空间区域的几率。
作为物质的最小粒子,原子的主要特性不是指原子模型的表面特征,而是指它吸收和发射能量的方式。
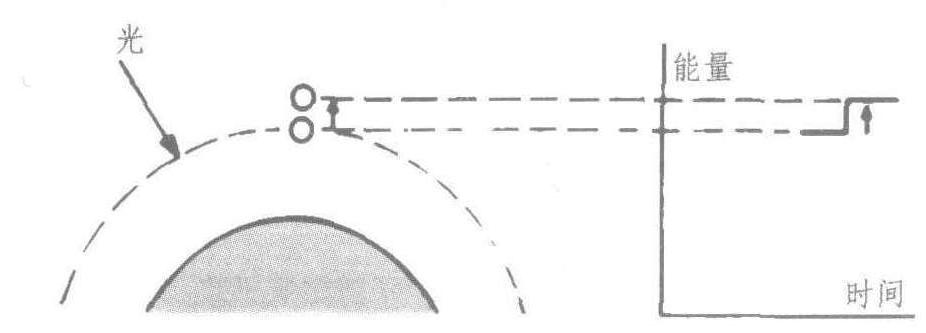
当原子吸收能量时(受适当波长的光照射),其电子跳到一个较高的能量层。
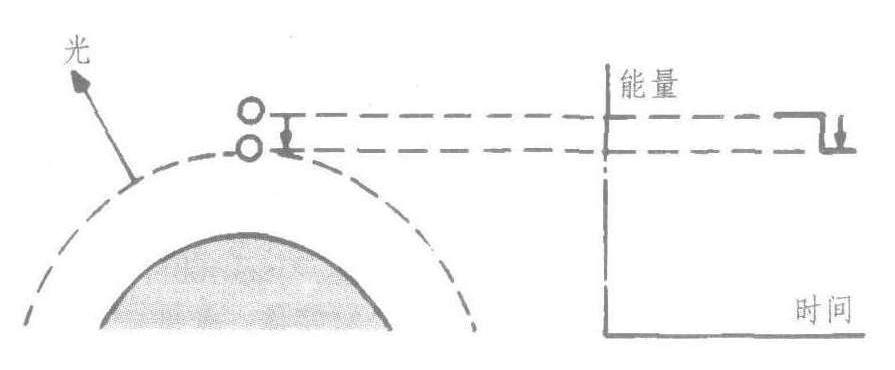
当这些电子跌落到原来的位置(基态)时,它们就放出能量(以光、紫外线等形式)。
根据现代物理学理论,所有的物质,即所有的原子都由两种粒子构成:轻子和夸克。电子即轻子;原子核的粒子(质子和中子)各自由3个夸克的不同排列构成。

最简单的原子核为氢原子核,只有一个质子。

氢原子的同位素重氢的核由一个质子和一个中子组成。
其他所有的原子核都由质子和中子的不同排列而成。碳原子核由6个质子和6个中子组成。